玉米从种子萌发、营养生长到生殖生长的整个发育周期,都依赖于稳定的环境温度。低温会明显影响到玉米的生长,低于17℃时,玉米生长发育阻滞;8℃低温下,玉米发生严重损伤;4℃以下,玉米萎蔫死亡。萌发期冷害会影响玉米种子的萌发,东北地区玉米播期在4月中旬~5月中旬之间,是玉米种子萌发的关键时期,其最低温度在5~15℃之间。当温度低于15℃会对玉米造成萌发期的冷害胁迫[1]。6~8℃时玉米种子不萌发,出苗率低[2]。玉米种子萌发过程中温度越低,种子萌发所需要的时间就越长,种子萌发率和发芽势越低,对玉米产量造成严重的影响[2]。
目前的研究显示,玉米全面的耐冷分子机制尚不明晰,多数参与耐冷分子调控机制的玉米基因通过异源表达的方法,在拟南芥和烟草的基础上进行功能研究。但是,单子叶植物拟南芥和烟草与双子叶植物玉米在生理和遗传基础上都存在显著差异,在玉米中的拟南芥同源基因的功能也有不同,这要求对玉米耐冷分子机制进行更加详细的分析,利用现代生物技术从不同角度发掘玉米耐冷性相关基因成为当前的研究热点。
经典的ICE-CBF-COR冷响应途径在玉米中也进行了研究,低温胁迫下,玉米中的CBF基因ZmDREB1A、ZmDREB2A、ZmDBP3和ZmDBP4上调表达。但多数玉米冷响应基因是通过在拟南芥和烟草中异源表达进行功能研究的。已有研究报道,在拟南芥中过表达ZmDREB1A(拟南芥DREB1s/CBFs的同源基因)、ZmDBP3和ZmDBP4能够增强拟南芥的耐冷性[3]。拟南芥AtCBF1基因遗传转化玉米自交系后,可以降低玉米在低温胁迫下的电解质渗漏率,提高玉米耐冷性[4]。这些研究表明,ICE-CBF-COR通路在不同物种中较为保守,在玉米和拟南芥调控低温胁迫的过程中发挥着相似的功能[5]。并有研究发现ZmDREB1A通过结合到ZmRAFs的启动子区正调控ZmRAFs的转录,提高玉米的耐冷性[6]。此外,在拟南芥icel-2突变体中异源表达玉米亲缘种中的低温相关基因ZmmICEl可以提高拟南芥耐冷性[7]。在烟草中超表达ZmMKK1基因能够增强对低温的耐受性,诱导更多的ROS相关基因和胁迫相关基因的表达,增强玉米耐冷性[8]。丝裂原活化蛋白激酶(MAPK)通路在玉米低温胁迫响应机制中发挥着重要的作用,在烟草中过表达ZmMPK17和ZmMKK1均可提高烟草耐冷性[9]。在拟南芥中过表达ZmMKK4可以提高拟南芥耐冷性[10]。玉米ZmMPK5也参与了植物在低温胁迫中的恢复生长[11]。
二酰甘油激酶(DGK)是一种独特的磷脂激酶,可以催化DAG的磷酸化产生PA。DGK基因家族成员己经在哺乳动物、果蝇、线虫和拟南芥等许多生物中被发现及鉴定。在植物营养生长、生殖生长和胁迫反应中,DGK存在结构复杂性和功能多样性。在植物中,DGK基因被分为三个不同的簇:簇I、Ⅱ和Ⅲ[12]。簇I DGK具有一个保守的DGKc结构域(催化DAG激酶结构域),一个DGK激酶辅助结构域DGKa,两个C1型结构域(富含半胱氨酸的DAG结合结构域)和一个将其定位到膜上的跨膜结构域[13]。而属于簇Ⅱ和Ⅲ的DGK基因仅保留了催化(DGKc)和辅助(DGKa)结构域[14]。DGK酶的C1结构域究竟是与DAG结合还是为DGK酶提供催化活性仍存在争议。虽然植物簇Ⅱ和簇Ⅲ中DGK没有C1结构域,但仍具有酶活性,这说明C1结构域并不是DGK酶活性所必需的结构域。DGK的C1结构域可能更倾向于与蛋白质伴侣结合而不是与DAG结合,这将为DGK酶在空间上和功能上与其他酶的结合提供可能。
已有研究表明,DGK基因参与植物的低温胁迫响应。在拟南芥细胞悬浮液中,PLC/DGK通路在低温胁迫下被激活[15]。在本课题组前期研究中,通过PLC/DGK途径产生的PA是在轻度冷胁迫下积累的,低温处理12h后,7个ZmDGKs转录物均被显著诱导,其中ZmDGK2和ZmDGK5分别上调3.8倍和4.5倍[16]。在玉米根和叶片中,DGK基因在低温胁迫30min内上调表达[17]。早期研究表明PLC/DGK途径有助于PA在早期低温胁迫期间的积累[18]。近期,在拟南芥低温胁迫研究中明确表明,DGK基因在植物低温响应机制中发挥着功能,包括调节三酰甘油(TAG)、DAG和PA的稳态[19]。越来越多的研究表明,缺乏头部基团的极性脂质PA可以与MGDG或DAG形成不稳定的六边形(HⅡ),在低温诱导的脱水过程中破坏细胞膜[20]。相反,去除这些脂质可能会阻止HⅡ的形成,并促进低温胁迫后的恢复。AtDGK2,AtDGK3,和AtDGK5的缺失提高了植物的耐冷性,并减缓了植物在低温胁迫下PA的产生[21]。
磷脂酸PA作为一种重要的脂质信号分子及第二信使,在低温响应中发挥着重要作用。DGK通过磷酸化由PLC水解产生的DAG生成PA(图1-1)。以往的研究多集中于PLD途径,认为植物中PA主要由PLD途径生成,对DGK途径的研究较少。但是近年来的研究表明PLC/DGK途径PA在植物生长发育和胁迫响应过程中发挥着重要的作用。PA能够通过静电-氢键结合的方式激活或抑制不同的下游靶蛋白。目前在植物中鉴定的PA靶蛋白多数是PLD途径PA的结合蛋白,DGK途径PA与下游靶蛋白的作用以及其参与胁迫响应的模式尚需更多的试验证据。
在模式植物拟南芥中,10℃以下的低温会引起PA的快速积累,0℃以下的冻害会导致PA含量增加10倍以上[22]。低温处理下水稻幼苗中PA也显著升高[23]。对玉米叶片的脂质组学分析显示,在低温处理下,PC对PA的转化率增加,导致PA增加,PC减少[24]。AtDGK2/3/5基因的突变体在0℃以下的冻害中表现出明显的耐冷表型,其耐冷性被认为与DGK突变引起的PA含量降低及依赖于RBOHD途径的ROS水平下降相关[21]。PA还介导了大麦的低温反应。叶片中的PA与根中的PA脂肪酸组成不同。内源性DAG和PA的磷酸化在叶片中比在根中更活跃,而且它们对低温的反应也不同[25]。此外,大麦短期(0~180min)低温胁迫导致幼叶PLD/PA快速而短暂地升高,脯氨酸和ROS水平升高。在长期(24~36h)低温胁迫后,幼叶和根中的PLD/PA显著降低,而根中的脯氨酸合成和ROS信号显著增加[26]。PA作为其他信号分子的前体参与了多种信号通路。因此,未来对低温胁迫下植物PA调控原理的研究应考虑PA与其他信号的串扰。PA通过结合调节一系列蛋白的活性和细胞内分布,从而参与多种信号通路,调节植物生长,但其与ABA及ROS信号途径的关系还需要深入研究。PA结合的有规律区域的特征还没有被发现,PA相互作用位点很难寻找和界定,有时只是一个或者几个正电荷位点氨基酸,或者只是疏水区域。因此现在对于PA的靶蛋白特征,基本的结合氨基酸位点还有没有被阐明。
在植物中,活性氧(ROS)作为细胞的第二信使,能够诱导钙信号和放大冷信号。植物中的ROS具有两方面的作用:其一,它是一种信号传导分子,调节涉及植物生长发育的多个方面,以及植物对环境胁迫的反应。其二,在胁迫下,它是细胞有氧代谢产生的一种有毒的副产物。当ROS种类的积累增加到超过一定阈值时,会产生毒性。并可能导致细胞膜脂质过氧化、DNA损伤、蛋白质变性、碳水化合物氧化、色素分解和酶活性受损。
植物低温胁迫的诱导反应与ROS的产生有关。PA是中心脂质信号分子并连接着信号网络中的不同成分,如ROS的产生[27]。在植物中,ROS的产生是由NADPH氧化酶驱动的[28]。在烟草的隐地蛋白处理过程中,DGK显著增加了烟草NADPH氧化酶的活性[29]。拟南芥中PLDα1的下调表达降低了叶片中ROS的产生,而在pldα1突变体中添加PA恢复了ROS的产量[30]。在拟南芥中,检测发现pldα1突变体PA的积累变少,从而增强了拟南芥的耐冷性[31],而pldδ突变体降低了拟南芥耐冷性[32]。这可能是由PLDα1触发的ROS产生和PLDδ介导的ROS缓解引起的[33]。PA结合蛋白参与感知和传递应激信号的过程,其中包括NADPH氧化酶蛋白D(RBOHD)。在胁迫应激环境下,RBOHD是ROS产生的关键组成部分。研究表明,RBOHD可以被PA激活,而PLDα1衍生的PA在非生物胁迫下直接与RBOHD相互作用[34]。低温胁迫下,DGK2/3/5也参与了拟南芥PA的生成。PA水平升高可能会破坏膜的通透性和完整性,或刺激RBOHD活性以产生ROS,使植物对低温更加敏感[21]。
五、主要参考文献
[1] Guy C. Molecular responses of plants to cold shock and cold acclimation [J]. J. Mol. Microbiol Biotechnol, 1999, 1 (2):231.
[2] Takahashi D, Uemura M, Kawamura Y. Freezing Tolerance of Plant Cells: From the Aspect of Plasma Membrane and Microdomain [J]. Adv. Exp. Med. Biol., 2018, 1081:61.
[3] Vigh L, Nakamoto H, Landry J, et al. Membrane regulation of the stress response from prokaryotic models to mammalian cells [J]. Ann. N Y Acad. Sci., 2007, 1113:40.
[4] Lyons J M J A R o P B. Chilling Injury in Plants [J]. 1973, 24 (1):445.
[5] Kodama H, Horiguchi G, Nishiuchi T, et al. Fatty Acid Desaturation during Chilling Acclimation Is One of the Factors Involved in Conferring Low-Temperature Tolerance to Young Tobacco Leaves [J]. Plant Physiol., 1995, 107 (4):1177.
[6] Thompson G A. Molecular Changes in Membrane Lipids During Cold Stress[C] Environmental Stress in Plants. Berlin, Heidelberg: 1989: 249
[7] Gu Y, He L, Zhao C, et al. Biochemical and Transcriptional Regulation of Membrane Lipid Metabolism in Maize Leaves under Low Temperature [J]. Front. Plant Sci., 2017, 8:2053.
[8] Taylor A O, Slack C R, McPherson H G. Plants under Climatic Stress: VI. Chilling and Light Effects on Photosynthetic Enzymes of Sorghum and Maize [J]. Plant Physiol., 1974, 54 (5):696.
[9] Chinnusamy V, Zhu J, Zhu J K. Cold stress regulation of gene expression in plants [J]. Trends Plant Sci., 2007, 12 (10):444.
[10] Dowgert M F, Steponkus P L. Behavior of the Plasma Membrane of Isolated Protoplasts during a Freeze-Thaw Cycle [J]. Plant Physiol., 1984, 75 (4):1139.
[11] Steponkus P L, Lynch D V. Freeze/thaw-induced destabilization of the plasma membrane and the effects of cold acclimation [J]. J Bioenerg Biomembr, 1989, 21 (1):21.
[12] Pearce R S, Ashworth E N. Cell shape and localisation of ice in leaves of overwintering wheat during frost stress in the field [J]. Planta, 1992, 188 (3):324.
[13] Yu X M, Griffith M. Antifreeze proteins in winter rye leaves form oligomeric complexes [J]. Plant Physiol., 1999, 119 (4):1361.
[14] Bilska A, Sowinski P. Closure of plasmodesmata in maize (Zea mays) at low temperature: a new mechanism for inhibition of photosynthesis [J]. Ann. Bot., 2010, 106 (5):675.
[15] Yang Y J, Chang W, Huang W, et al. The effects of chilling-light stress on photosystems I and II in three Paphiopedilum species [J]. Bot. Stud., 2017, 58 (1):53.
[16] Bernhard Teicher H, Lindberg M?ller B, Vibe Scheller H. Photoinhibition of Photosystem I in field-grown barley (Hordeum vulgare L.): Induction, recovery and acclimation [J]. Photosynth Res., 2000, 64 (1):53.
[17] Sonoike K. Photoinhibition of photosystem I [J]. Physiol. Plant., 2011, 142 (1):56.
[18] Tikkanen M, Mekala N R, Aro E M. Photosystem II photoinhibition-repair cycle protects Photosystem I from irreversible damage [J]. Biochim Biophys Acta., 2014, 1837 (1):210.
[19] Triantaphylidès C, Krischke M, Hoeberichts F A, et al. Singlet oxygen is the major reactive oxygen species involved in photooxidative damage to plants [J]. Plant Physiol., 2008, 148 (2):960.
[20] Kingston-Smith A H, Foyer C H. Bundle sheath proteins are more sensitive to oxidative damage than those of the mesophyll in maize leaves exposed to paraquat or low temperatures [J]. J. Exp. Bot., 2000, 51 (342):123.
[21] Zhang L T, Zhang Z S, Gao H Y, et al. Mitochondrial alternative oxidase pathway protects plants against photoinhibition by alleviating inhibition of the repair of photodamaged PSII through preventing formation of reactive oxygen species in Rumex K-1 leaves [J]. Physiol. Plant, 2011, 143 (4):396.
[22] Geissler N, Hussin S, Koyro H W. Interactive effects of NaCl salinity and elevated atmospheric CO2 concentration on growth, photosynthesis, water relations and chemical composition of the potential cash crop halophyte Aster tripolium L [J]. Environmental and Experimental Botany, 2009, 65 (2):220.
[23] Yun J G, Hayashi T, Yazawa S, et al. Acute morphological changes of palisade cells ofSaintpaulia leaves induced by a rapid temperature drop [J]. Journal of Plant Research, 1996, 109 (3):339.
[24] Takahashi S, Badger M R. Photoprotection in plants: a new light on photosystem II damage [J]. Trends Plant Sci., 2011, 16 (1):53.
[25] Bonnecarrère V, Borsani O, Díaz P, et al. Response to photoxidative stress induced by cold in japonica rice is genotype dependent [J]. Plant Sci., 2011, 180 (5):726.
[26] Zandalinas S I, Mittler R. ROS-induced ROS release in plant and animal cells [J]. Free Radic. Biol. Med., 2018, 122:21.
[27] Torres M A. ROS in biotic interactions [J]. Physiol. Plant, 2010, 138 (4):414.
[28] Apel K, Hirt H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction [J]. Annu. Rev. Plant Biol., 2004, 55:373.
[29] Ray P D, Huang B W, Tsuji Y. Reactive oxygen species (ROS) homeostasis and redox regulation in cellular signaling [J]. Cell Signal, 2012, 24 (5):981.
[30] Campos C N, ávila R G, de Souza K R D, et al. Melatonin reduces oxidative stress and promotes drought tolerance in young Coffea arabica L. plants [J]. Agricultural Water Management, 2019, 211:37.
[31] Lee D H, Lee C B. Chilling stress-induced changes of antioxidant enzymes in the leaves of cucumber: in gel enzyme activity assays [J]. Plant Sci., 2000, 159 (1):75.
[32] Kocsy G, Szalai G, Galiba G. Induction of glutathione synthesis and glutathione reductase activity by abiotic stresses in maize and wheat [J]. ScientificWorldJournal, 2002, 2:1699.

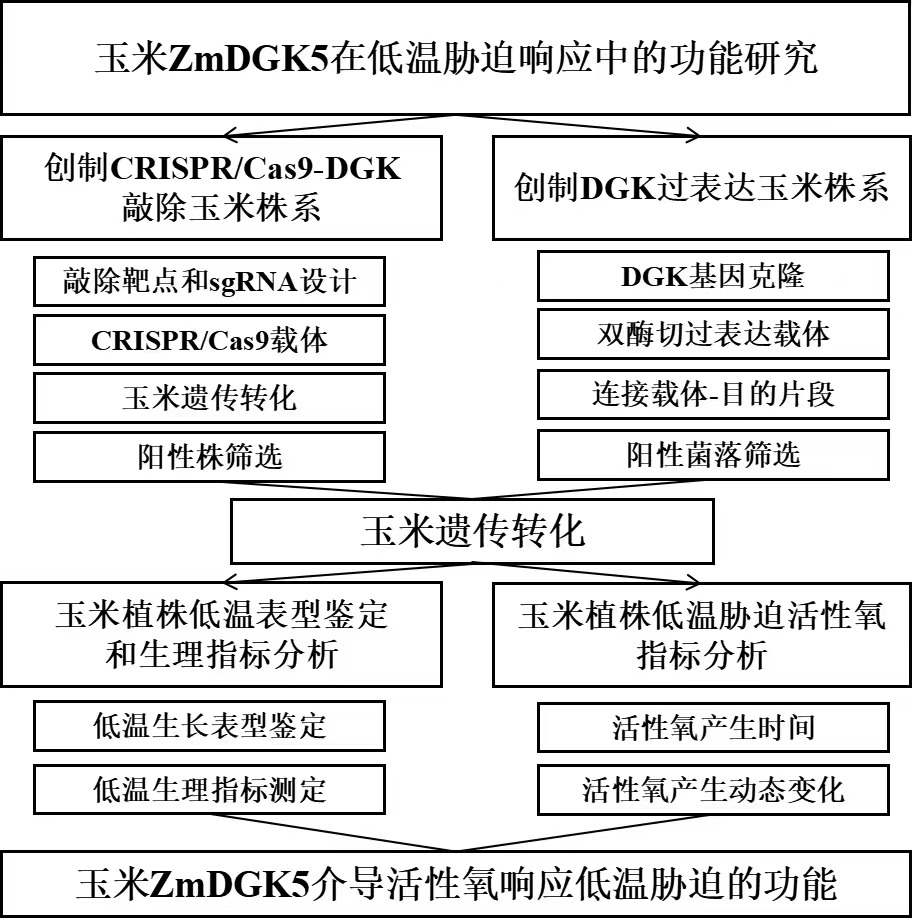 (1)技术路线
(1)技术路线