科研项目名称:猪精液负压液态17℃保存及机理的研究
项目编号:LBH-Q18100
批准部门:黑龙江省人社厅
2019.01-2020.12
科研项目名称:基于微流控技术研究层流剪切力对猪早期胚胎体外发育的影响机制
项目编号:C2017053
批准部门:黑龙江省自然科学基金面上项目
科研项目名称:猪精液负压液态17℃保存及机理的研究
项目编号:LBH-Q18100
批准部门:黑龙江省人社厅
2019.01-2020.12
科研项目名称:基于微流控技术研究层流剪切力对猪早期胚胎体外发育的影响机制
项目编号:C2017053
批准部门:黑龙江省自然科学基金面上项目
| 序号 | 学生 | 所属学院 | 专业 | 年级 | 项目中的分工 | 成员类型 |
|---|---|---|---|---|---|---|
|
|
阚兴旭 | 动物科技学院 | 动物科学 | 2022 | 策划书编辑 |
|
|
|
潘汶琦 | 动物科技学院 | 动物科学 | 2022 | 精液处理 |
|
|
|
周杨 | 动物科技学院 | 动物科学 | 2022 | 质量检测 |
|
|
|
游雨欣 | 动物科技学院 | 动物药学 | 2023 | 精液的采集 |
|
|
|
李子仪 | 动物科技学院 | 动物科学 | 2022 | 数据分析 |
|
| 序号 | 教师姓名 | 所属学院 | 是否企业导师 | 教师类型 |
|---|---|---|---|---|
|
|
李井春 | 动物科技学院 | 否 |
|
本项目主要针对精子在冷冻和解冻过程中,氧化应激对精子所造成的不良影响,它不仅能够直接损害精子结构,还会在冷冻-解冻过程中削弱精子质膜、顶体、DNA以及线粒体的完整性。这种损害会导致精子细胞失去原有的正常生理功能,降低其在冷冻-解冻后的质量。为减轻猪精子在冷冻过程中因氧化应激而遭受的损伤,我们选择在稀释液中添加MitoQ,并筛选出对猪精液冷冻保存具有显著效果且在冷冻过程中能有效保护线粒体的最佳药物浓度,提高猪精液冷冻保存的质量,为猪精液保存方法带来一种创新且有效的策略。同时,让学生在项目研究的过程中学习和掌握专业技能,提高大学生自主创新研究能力。
目前,人工授精在畜牧业广泛应用,但由于公猪精液冷冻保存的质量在很大程度上会因膜脂质过氧化而降低,因此很少用于人工授精。在养猪业中,精液的保存主要采用常温保存法,即保存在17℃。尽管这种方法操作简便,无需特定的设备和场地,但其局限性在于保存时间相对较短。通常在48小时后,常温保存的精子的活力和品质会显著下降,这直接影响了母猪的受胎率和活胎率。因此,研究者们一直在探索稀释液配方的改良,例如添加抗氧化剂和精子质膜保护剂等方法,以延长精液保存时间并提高精子质量。冷冻保存技术被公认为长期保存精液的最有效手段,尽管其操作过程相对复杂,但该技术与人工授精技术的结合,在猪精子资源的长期保存以及提高生产繁育效率等方面展现出了显著的积极作用。通过冷冻精液技术,我们可以有效地长期保存优质公猪的精液,突破地域和时间的限制,实现种质资源的跨地区甚至跨国引进。精液在冷冻储存过程中,可以有效地降低疾病传播的风险。这对于控制疾病的传播、保护猪群健康具有重要意义。精液在冷冻保存过程中,多种因素诱发精子损伤,如渗透压变化、温度波动和氧化应激,其中氧化应激成为了损害精子质量的主要因素。精子在保存过程中不断有活性氧(Reactiveoxy
species, ROS)产生,低水平的ROS能调节精子获能和顶体反应等过程,但当ROS产生过多超过机体的清除能力,就会造成精子活率和活力降低,并增加氧化应激。线粒体,作为细胞中ROS主要来源部位,同时也是机体诸多关键代谢和生理过程的核心场所。线粒体内部的氧化磷酸化酶系统扮演着至关重要的角色,它能够催化有机物的氧化还原反应,进而合成ATP,为细胞能量代谢提供了不可或缺的动。为了缓解氧化应激对精子的负面影响,采用外源抗氧化剂可以显著抑制并清除ROS,保护精子细胞不受损害,进而提高精液的总体质量。这一发现不仅为猪人工授精技术的推广提供了坚实的理论依据,也为生产实践带来了积极影响。此外,大创学生在参与猪精液冷冻保存的研究过程中,不仅能够深化专业理论知识,还能锻炼实验技能,进一步培养自主创新能力,为未来的科研工作奠定坚实基础。
2.1
MitoQ对猪冷冻精子质量的影响
①MitoQ对猪冻精活力的影响
②MitoQ对猪冻精运动能力参数的影响
2.2
MitoQ对猪冷冻精液抗氧化能力的影响
①MitoQ对猪冻精的丙二醛/MDA含量的影响
②MitoQ对猪冻精的超氧化物歧化酶/SOD含量的影响
③MitoQ对猪冻精的谷胱甘肽过氧化物酶/GSH-Px含量的影响
④MitoQ对猪冻精的活性氧/ROS含量的影响
2.3
MitoQ对猪冻精功能完整性及线粒体活性的影响
①MitoQ对猪冻精的质膜完整性的影响
②MitoQ对猪冻精的DNA完整率的影响
③MitoQ对猪冻精的线粒体活性的影响
④MitoQ对猪冻精的顶体完整性的影响
Mito Q,是典型的线粒体靶向抗氧化剂,由四苯基膦(TPP)和泛醌组成的有机化合物,具有清除自由基、具有抗癌、抗炎与抗氧化等优点。
MitoQ作为一种泛醌的衍生物,它通过一个脂肪族碳链与亲脂性的三苯基膦阳离子形成共价键,从而实现对于线粒体的靶向作用[1]。因为线粒体膜电位较高,阳离子在细胞内的线粒体内积累,并且泛醌能够部分地嵌入到脂质双层中,通过呼吸链发生还原反应。MitoQ传递泛醌主要被呼吸链中的复合物 II 还原为泛醇[2], 泛醇是一种断链抗氧化剂,通过将其羟基的氢原子提供给脂质过氧自由基,从而有效减少线粒体内膜的脂质过氧化程度,进而保护线粒体免受氧化应激的损害。[3]。有报导称,在稀释液中添加不同浓度MitoQ,可显著降低公鸡冻精中ROS水平,并提高精子质量[4]。不仅如此,Liu 等人,在水牛的冻精中也发现了类似趋势[5]。吕松洁等将不同浓度的MitoQ添加湖羊冷冻精液中,结果表明添加后的湖羊精液可显著降低精子ROS与丙二醛(malonaldehyde,MDA)水平,提高谷胱甘肽过氧化物酶(Glutathione peroxidase GSH-Px)水平[6]。精子的运动性能是衡量其受精能力的重要标准之一,这种运动能力对于精子与卵细胞成功结合至关重要。吕松洁等人研究了在精液基础稀释液(BTS)中添加不同浓度MitoQ对湖羊精液质量及抗氧化酶活性的影响。在稀释剂中添加不同浓度为0、50、100、150、200nmol/L的 MitoQ,采用CASA全自动精子分析仪和荧光探针技术,我们分别评估了精子的运动学参数和功能完整性。在实验中,我们发现150nmol/L的MitoQ处理组在抗氧化活性方面表现最佳,与其他组相比具有显著优势。然而,当MitoQ的添加浓度增加至200nmol/L时,精子的抗氧化活性相较于150nmol/L组显著降低,差异具有统计学意义(P<0.05)。综上所述,在湖羊精液稀释液中添加MitoQ 能够有效改善精子在冷冻保存过程中的品质,其中150nmol/L的添加量效果最为显著。然而,关于MitoQ对猪冷冻精液抗氧化性能的具体影响,目前尚未有相关的报道和研究。
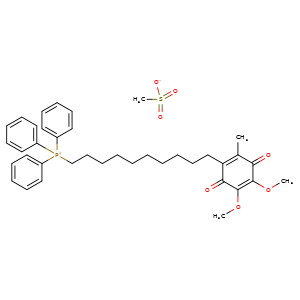
图1.MitoQ分子结构
因此,当前猪精子的冷冻保存方法尚需进一步完善。鉴于MitoQ在精子冻融损伤保护方面展现出的潜力,以及其在该领域作为研究热点的地位,目前关于在猪精子冷冻保护液中添加MitoQ的研究仍显不足。本研究聚焦于在猪冷冻精液稀释液中添加MitoQ,旨在全面探讨MitoQ对猪冷冻精液保存质量的影响及其潜在的保护机制。我们将研究MitoQ对冷冻精子质量、抗氧化能力、活性氧含量、精子功能完整性(包括DNA完整性和顶体完整性)、线粒体活性以及凋亡相关基因(如Bcl-x1、Bcl-x2)表达的影响。通过深入剖析精子冷冻过程中的氧化性损伤,期望为猪精液冷冻技术的改进提供新的见解和策略。本项目团队经过前期细致的实验,已经熟练掌握了猪精液冷冻保存的关键技术。针对冷冻过程中精子活力下降、质膜完整性受损等核心问题,我们进行了深入研究。前期实验数据表明,通过在猪精液中添加如芒果苷、人参多糖、辅酶Q等保护精子的物质,能够显著改善猪精子在冷冻保存过程中的质量问题。这些前期实验成果和丰富的研究基础,为本项目的顺利实施和后续深入探索提供了坚实的基石和有力的保障。
参考文献
[1] Kelso GF, Porteous CM, Coulter CV, et al. Selective targeting of a redox-active ubiquinone to mitochondria within cells: antioxidant and antiapoptotic properties[J]. J Biol Chem. 2001 Feb 16;276(7):4588-96.
[2] Ross MF, Prime TA, Abakumova I, et al.Rapid and extensive uptake and activation of hydrophobic
triphenylphosphonium cations within cells[J].
2008 May 1;411(3):633-45.
[3] Rezaei A, Bahmani HR, Mafakheri S, et al. Protective effects of different doses of MitoQ separately
and combined with trehalose on oxidative stress and sperm function of
cryopreserved Markhoz goat semen[J]. Cryobiology. 2023 Mar;110:36-43.
[4] Nazari M, Daghigh-Kia H, Mehdipour
M, et al.
Comparison of the performance of targeted mitochondrial antioxidant mitoquinone
and non-targeted antioxidant pentoxifylline in improving rooster sperm
parameters during freezing and thawing[J]. Poult Sci. 2022
Sep;101(9):102035.
[5] iwari S, Mohanty TK, Bhakat M, et al.Comparative
evidence support better antioxidant efficacy of mitochondrial-targeted
(Mitoquinone) than cytosolic (Resveratrol) antioxidant in improving in-vitro
sperm functions of cryopreserved buffalo (Bubalus bubalis) semen[J].
Cryobiology. 2021 Aug;101:125-134.
[1] 吕松洁,付丽,范文华,张树山,吴彩凤,徐皆欢,戴建军,张德福.线粒体靶向抗氧化剂Mitoquinone对湖羊冻精损伤的保护作用[J].畜牧兽医学报,2019,50(12):2554-2559.
本项目以降低氧化应激对猪精子冷冻损伤为挑战,通过不断优化MitoQ的浓度,显著提升精子冷冻保存后的质量,从而为人工授精技术提供稳定且优质的精液来源,为养殖行业的可持续发展贡献一份力量。同时,我们也将培养大学生的独立创新研究能力作为重要目标。在项目实施过程中,项目组成员将全程参与,从申请书的撰写、项目执行到结果分析、结题总结,每一个环节都将成为他们锻炼和提升能力的宝贵机会。通过这样的实践,学生们将能够深入掌握相关专业知识理论和实验技能,为未来在科研领域的发展奠定坚实的基础。
5.1技术路线图
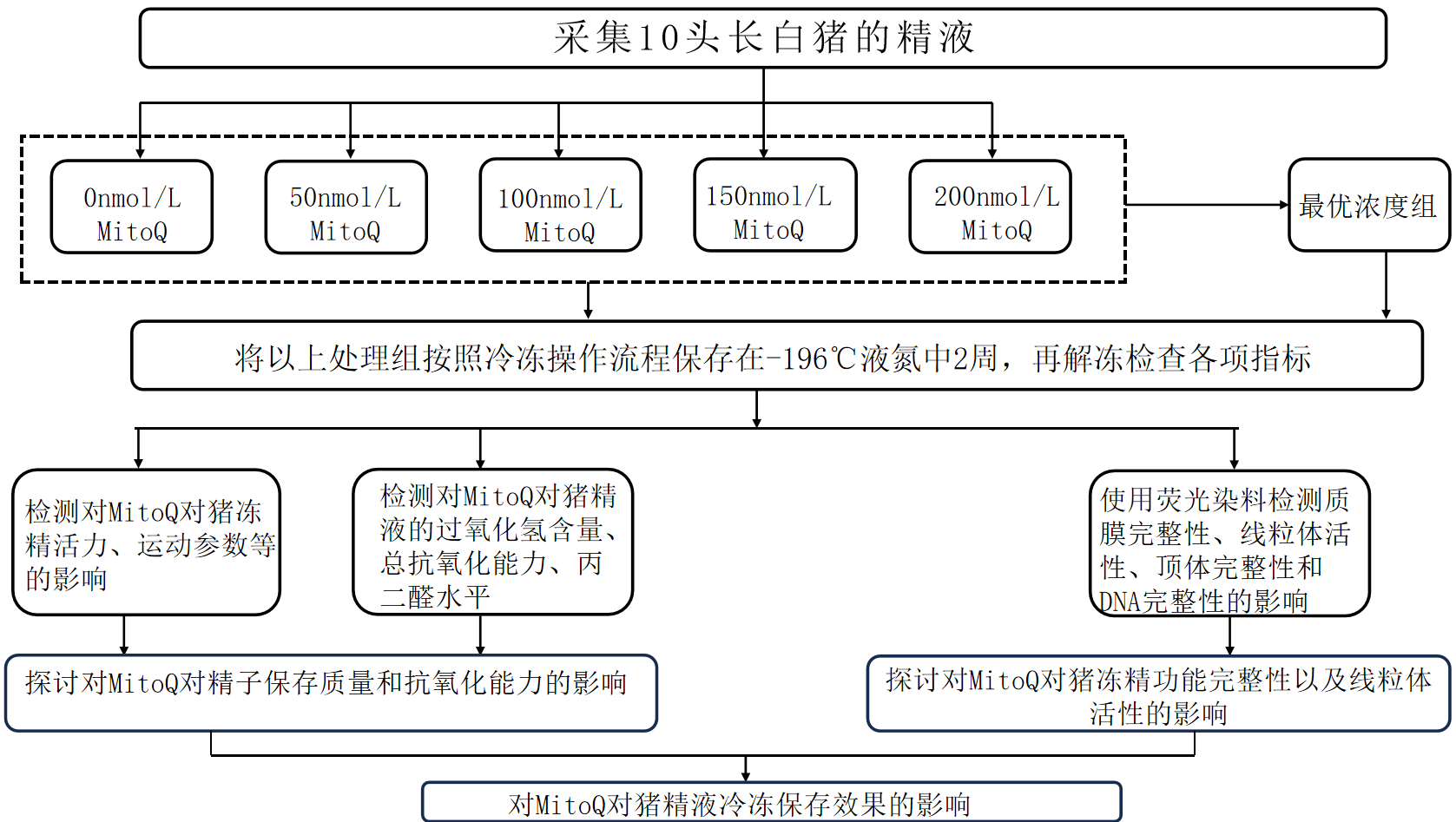
5.2拟解决问题
手握法采集来自黑龙江省大庆精育种公猪站的10头2-3岁的长白种公猪。精子放在37°C 的恒温箱中 ,1小时内送往实验室。若检测结果显示精子活力超过80%,密度达到2亿以上,颜色呈现灰色或乳白色,且无异常气味,仅带有轻微的腥味,那么这些精子将被视为合格的精液。根据实验设计将原精液密度调整成1×108 个/mL,储存在17℃恒温箱内,等待参与后续试验。
采用 Pei 等(2018)的试验方法并优化。选取活率高的精子,测定鲜精的温度,使其与稀释液的温度差异在 1-3℃,样品在室温下放置 5min,减少温度对精子的影响。
为了减少个体差异的影响将采集的精液混合均匀。按照 1:1 加入到等温的Modena溶液中,用10 层纱布进行包裹,缓慢放入 17℃的箱中进行保存,放置 0.5-1.5 h,在这期间每隔半个小时轻微地进行震荡,避免精子以假死的状态存在,提高实验的可靠性与准确性。平衡结束后将精液分组,分装到 10 mL 的离心管中,管中的精液为 7-9 mL。离心样品( 17℃ 120 × g , 10 min)离心后弃上清,得到的沉淀大约0.5mL ,向沉淀物中加入冷冻基础液(实验室自制)1 mL,混合均匀,随后按照既定的浓度加入MitoQ,再加入 1.5 mL 的TCG,一共加入
2.5 mL,轻晃混合均匀。接着用 10 层纱布进行包裹放置于4℃进一步平衡(2-3 h),结束后,用等温标记 0.25mL 的冷冻细管,使用封口粉进行封管。在精液平衡的同时,我们预先设置好程序冷冻仪。起始温度为4℃,降温速率定为1℃/min。随后,将冷冻精液细管放入程序冷冻仪中。当温度逐渐降低到-5℃时,迅速将细管转移到液氮箱中,距离液氮表面3cm进行熏蒸处理,时间为10min。最后,将细管放置在-196℃的液氮罐中,进行为期2周的保存,以备后续实验使用。
经过两周的液氮保存后,将适量的猪精液解冻液加入到10ml的离心管中,然后将离心管置于37℃的水浴锅中预热5 min。接下来,精液细管从液氮罐中取出,立即被放入水浴锅中进行快速解冻(45s)。解冻完成后,使用剪刀将细管两端剪断,使精液与解冻液充分混合均匀。接着,将含有混合液的离心管再次放入37℃的水浴锅中进行保温。以便进行后续实验的各项测定。
①精子活力测定
精子活力是指精液样本中直线前行的精子所占精子总数的百分比,这一指标是评估精子运动性能的重要指标。精子活力=活着精子数/计数的精子总数×100%。使用移液器,从解冻后的精液中吸取10μL,并小心地将其置于载玻片上,随后覆盖上盖玻片。用精子质量分析仪进行检测精子的活力。
②精子活率的测定
精子活率是衡量精液中活精子占比的重要指标之一。精子活率=直线前行的精子/计数的精子总数×100%。使用移液器,从解冻后的精液中吸取10μL,并小心地将其置于载玻片上,随后覆盖上盖玻片。使用精子质量分析仪进行检测精子的活率。
使用 CASA 系统分析精子的活率,使用移液器将 100 μL 样品加到 Modena稀释液中,37℃水浴10 min,吸取 10 μL 置于载玻片中,然后放置在恒温载物台上,调节图像进行分析。
③精子运动参数测定
根据实验设计,在保存不同的时间内,用移液器分别移取15 μL,在37°C的二氧化碳培养箱中预热15分钟,随后精液滴在载玻片上。接着,利用全自动精子分析仪对精子的路径速度、平均路径速度等关键质量参数进行检测和分析。
4.1.3 MitoQ对猪冷冻精液抗氧化能力的影响
①MitoQ对猪冻精的丙二醛 /(nmol/L) MDA含量的影响
为评估精子的脂质氧化程度,我们采用了碧云天生物技术有限公司的MDA(丙二醛)试剂盒进行检测。将精子密度调整为1×108个/mL,并向待检精液中加细胞裂解液150 μL,在完成裂解步骤后,对样本进行离心处理,离心条件为1600xg,持续10分钟。之后,取出100微升的上清液,将其加入到预先准备好的含有200微升MDA检测工作液的离心管中。充分混合后,将离心管置于水浴中加热15分钟,随后在水浴中冷却至室温。接下来,进行第二次离心,离心条件为1000xg,同样持续10分钟。从离心后的混合物中取出200微升的上清液,加入到96孔板中。最后,用酶标仪在532纳米波长处测定这些样本的吸光度。MDA值以μmol/mg为单位表示。
②MitoQ对猪冻精的超氧化物歧化酶 /(U/mL) SOD、GSH-Px、谷胱甘肽过氧化物酶含量的影响
精子抗氧化酶活性的测定
(1)取精液样品120μL,25℃ 离心( 1600×g
5 min),留沉淀部分。
(2)取 400 μL 1% Triton X-100 加入沉淀样品中 ,对细胞裂解 20min,提取抗氧化酶。
(3)上述得到的溶解物在25℃条件下 离心 (10000×
g 10 min),保留上清液,按照BCA蛋白测定试剂盒的说明书做操作,对上清液中的总蛋白浓度进行测定。
(4)使用南京建成生物 SOD 测定试剂盒、CAT 测定试剂盒以及 GSH-Px 测定试剂盒进行 SOD、CAT
以及 GSH-Px 酶活性的测定,酶的活力用 U/mg表示。以及 MDA试剂盒对 MDA 测定。使用公式计算MDA 含量,以nM/mg表示。
③MitoQ对猪冻精的活性氧/(U/mL) ROS含量的影响
为了测定精液的活性氧水平,首先将冷冻保存的精液进行解冻。解冻后,离心(800 ×g 10min),保留沉淀。沉淀物中加 DCFH-DC 工作液,使其覆盖沉淀,37℃暗室孵育 30min,后用 PBS
洗 3 次,洗去多余的染液。利用荧光酶标仪对样本进行测定,激发波长 488nm,发射波长 525nm,荧光值代表活性氧。
4.1.4 MitoQ对猪冻精功能完整性及线粒体活性的影响
采取SYBR- 14和碘化丙锭(PI)双重染色法评估精子质膜完整性。总结来说,每组取250μL样品,对其进行离心 (5
min, 290× g),移除上清液,将125 μL HEPES(含有10% BSA)缓冲盐溶液加入,随后添加5μL的SYBR-14工作液,并在37°C条件下孵育5分钟。紧接着,加入5μL的PI工作液,并将混合物放回37°C水浴中孵育5—10分钟。在载玻片上滴加10微升的样品,随后覆盖上盖玻片。随后,在暗室环境中,使用荧光显微镜对样本进行观察。每组选取5个视野区域,每个区域精子数量不少于100个精子。使用SYBR-14进行标记的绿色荧光精子拥有完整的质膜,而使用PI进行标记的红色荧光精子则显示出质膜受损,激发波长 488nm,发射波长 525nm,观察精子的质膜,并计算质膜完整率。
利用异硫氰酸荧光素标记的花生凝集素(FITC-PNA)染色技术,我们对精子的顶体进行了荧光染色。评估。取100 μL 的样品,涂在干净的载玻片上,自然风干,风干后甲醇固定10分钟,然后将等体积的FITC- PNA工作溶液均匀地覆盖在样品上,放置黑暗和潮湿条件下于37℃孵育30分钟,随后用羟乙基哌嗪乙磺酸(HEPES)冲洗并避光风干。在倒置荧光显微镜下进行顶体完整性的检测,每组随机选取5个视野,每个视野不少于100个精子。并将其分类为顶体完整或非顶体完整。激发光波长 480nm、发射光波长 530nm,观察精子的顶体,并计算顶体完整率。
应用吖啶橙染色法来评估DNA的完整性。经过染色后,样本被置于荧光显微镜下进行观测,并统计荧光精子的百分比。在这个过程中,确保每次计数的精子数量不少于200个。
采用JC-1检测方法评估精子的线粒体活性。从每个样品中取出250 μL,离心处理(5min,290 × g ),弃去上清液,向离心管中加入125μL的HEPES(10% BSA)缓冲液,接着添加10μL的JC-1工作溶液,在37℃下放置25—30分钟。将10微升样本置于载玻片上并盖上盖玻片,随后使用倒置荧光显微镜对精子线粒体活性进行荧光检测。在放大400倍的荧光显微镜下,随机选择五个视野,并在每个视野中评估不少于100个精子。具有高线粒体膜电位的精子呈现黄橙色,而线粒体膜电位低的精子呈现绿色。记录高线粒体活性精子的比例。激发波长488nm,发射波长 513nm,观察精子头部出现的颜色。
5.3预期成果
(1)通过本项目的全面系统研究,期望筛选出MitoQ在猪冻精中最佳浓度,通过试验指标的变化规律探讨出MitoQ抗氧化机制,为人工授精技术的完善以及现场生产提供理论依据。
(2)在学术刊物上发表研究论文2~3篇,其中1篇中文核心期刊论文。
利用猪精液冷冻保存技术,将MitoQ以不同浓度添加到稀释液中,研究其对冻融猪精子品质的影响,包括精子活力、抗氧化能力等指标;同时评估不同浓度MitoQ对精子运动学参数的影响。
本项目团队经过前期细致的实验,已经熟练掌握了猪精液冷冻保存的关键技术。针对冷冻过程中精子活力下降、质膜完整性受损等核心问题,我们进行了深入研究。前期实验数据表明,通过在猪精液中添加如芒果苷、人参多糖、辅酶Q等保护精子的物质,能够显著改善猪精子在冷冻保存过程中的质量问题。这些前期实验成果和丰富的研究基础,为本项目的成功推进和未来的深入探索已经建立了稳固的基础。
| 开支科目 | 预算经费(元) | 主要用途 | 阶段下达经费计划(元) | |
|---|---|---|---|---|
| 前半阶段 | 后半阶段 | |||
| 预算经费总额 | 10000.00 | 无 | 6000.00 | 4000.00 |
| 1. 业务费 | 4000.00 | 无 | 2000.00 | 2000.00 |
| (1)计算、分析、测试费 | 0.00 | 无 | 0.00 | 0.00 |
| (2)能源动力费 | 0.00 | 无 | 0.00 | 0.00 |
| (3)会议、差旅费 | 0.00 | 无 | 0.00 | 0.00 |
| (4)文献检索费 | 0.00 | 无 | 0.00 | 0.00 |
| (5)论文出版费 | 4000.00 | 论文的版面费用等 | 2000.00 | 2000.00 |
| 2. 仪器设备购置费 | 0.00 | 无 | 0.00 | 0.00 |
| 3. 实验装置试制费 | 0.00 | 无 | 0.00 | 0.00 |
| 4. 材料费 | 6000.00 | 用于购买猪精液、实验药品、实验试剂等费用 | 4000.00 | 2000.00 |