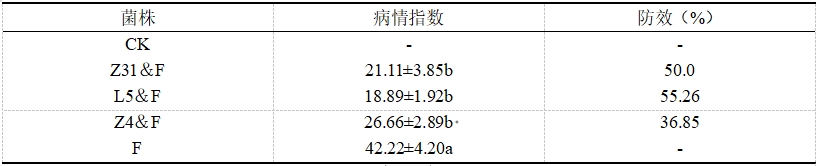
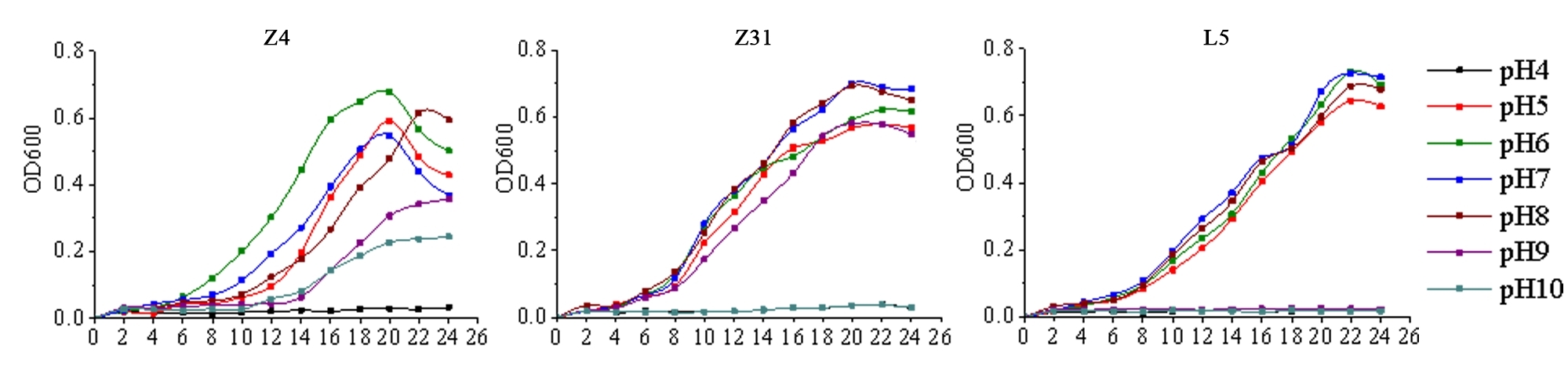
3.3土传病害的防治方法
3.3.1化学防治
在土传病害病发初期,应用化学药剂一种行之有效的防控措施。其中,甲基硫菌灵、腐霉利、菌核净、咪鲜胺、扑海因、丙环唑等对菌核病都有较好的控制效果,也可以通过喷雾与之配合使用。为了防止病虫害产生抗药性,在实际生产过程中我们应交替使用农药。
土壤熏蒸是一种通过施用化学熏蒸剂(fumigants)来杀死土壤中的有害生物(如病菌、昆虫和杂草)的农业技术。这种方法广泛用于农田、温室和苗圃中,以确保种植环境的健康和高效。常见的熏蒸药剂包括甲基溴、氯化苦、氯化镁和氯化铵、代森铵等,使用方法是将药物以气体的方式完全散布于土壤中,从而达到杀菌的目的。在进行土壤熏蒸时,要实现广谱灭菌,必须配套使用各种不同的灭菌药剂。
化学药剂虽然能有效控制病虫害和杂草,但也存在一些明显的缺点。这些缺点包括对环境的影响、对人类健康的潜在危害,以及对生态系统的破坏等。鉴于这些缺点,越来越多的农民和研究人员正在探索更加可持续和环保的农业病虫害防治方法,如生物防治、物理防治和综合病虫害管理等,以减少对化学药剂的依赖。
3.3.2农业防治
农业防治能够有效控制和减少土传病害发生和传播。在日常生产过程中,我们要及时清理作物的老叶黄叶,在收获之后,要及时拉秧,并进对土壤进行深翻和晾晒。也可以在撒上生石灰或秸秆(碎稻草或小麦秸秆等)后,对土地进行充分的翻耕,并用覆膜和浇水的方式,将其覆盖起来,并将其闷在大棚内7~15d,让土壤温度保持在40℃以上,从而将残余在大棚室内的病菌给消灭掉。
轮作:通过轮作不同的作物,可以打破病原体的生命周期,减少病害的发生。对有严重土传病害的田块,在进行土壤消毒前,应适度休耕。
选择抗性品种:种植经过培育具有抗病性的作物品种,可以有效减少病害发生。此外,将抗病砧木与高产接穗嫁接,结合两者的优点。
传统的农业防治只能缓解病虫害的发生,并不能完全控制其爆发,需要结合生物防治、化学防治、物理防治和农业措施等多种方法,可以更有效地防治病虫害,确保农业生产的可持续性。
3.3.3生物防治
生物防治是一种利用自然敌人、寄生物、病原体等生物手段来控制有害生物(病虫害)的农业防治方法。这种方法具有环境友好、可持续性强等优点,是现代农业病虫害综合管理(IPM)中不可或缺的部分(王丽丽等, 2019)。
生物防治是通过不同生物种群之间的相互作用来抑制植物病害的发生。生物防治具有环境友好、安全性高、可持续性强、抗性风险低等特点。因此,应用微生物控制植物病害已成为当前研究的热点。前人研究发现,从黄瓜根际土壤中筛选出3株菌株对黄瓜枯萎病病原菌具有强烈的拮抗作用(闫敏等, 2013)。王英姿等(2008)发现,木霉菌对黄瓜枯萎病也有较好的抑制效果,在降低化学农药使用的同时还能提升黄瓜的品质和产量。因此,生物防治作为一种环保、高效的病虫害防治方法,在农业上具有广阔的应用前景。
3.4生防细菌防治植物病害研究现状
3.4.1生防细菌的概况及其对土传病害的防治作用
近年来,随着生物防治技术的发展,有益菌的分离筛选工作得到了越拉越多人的关注,从植物根际土壤分离的有益菌为生防植物病害提供了丰富的菌种资源。例如,Solanki等(2014)通过从番茄根际土中分离得到9株拮抗立枯丝核菌的菌株,田间验证试验显示出较好的生防效果。Shen等(2005)从洋葱根际土中筛选到1株广谱拮抗菌普城沙雷氏菌(Serratia plymuthica)A21-4,对多种蔬菜病原微生物具有较强拮抗活性。欧阳晓伦等(2022)从银杏外种皮中分离筛选获得对灰梨孢菌、禾谷镰刀菌、藤仓镰刀菌、新月弯孢菌、串珠镰刀菌、尖孢镰刀菌6种供试植物病原菌均具有抑制作用,抑制率在60%~69%之间。此外,从水稻根部筛选出1株产铁载体的放线菌,该菌株具有促进植物生长的功效(Rungin et al., 2012)。一些内生真菌通过分泌次级代谢物或在土壤中改造一些能被植物吸收和利用的养分,也能防治植物病害并促进植物的生长发育(Ma et al., 2011)。结合目前国内外研究进展,芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、木霉菌属(Trichoderma)等生防菌在植物病害防控中应用广泛(Chowdappa et al., 2013; Ramos-Solano et al., 2014; Walia et al., 2014)。
3.4.2生防细菌的作用机理
生防细菌是一类分布广、种类繁多的菌株,其作用机理均为抑制病原微生物对宿主的危害(Bloemberg et al., 2001; Hong et al., 2011)。关于生防细菌能够促进植物生长和控制植物病害的机理,得到了人们的普遍认同,它们包括了:营养生态位竞争、产生抑菌物质、诱导植物抗性等(EL-Tarabily et al., 2006; Haas et al., 2000)。
(1)营养生态位竞争
在根际环境微环境下,根际生防菌能够通过快速占领养分来降低病害对养分争夺能力,从而达到防治病害的目的。例如,荧光假单孢菌(Pseudomonas fluorescens)因其生长速度快和侵袭力强,可在根系区域快速增殖并率先占据生态位(Marschner et al., 2004)。王小慧等(2012)也发现,通过添加无致病力的轮枝镰刀菌菌株XA,发现其可以降低西瓜根际病原菌的侵染,并可在西瓜根部进行高效的定殖,进而抑制病害的产生。
(2)产生抑菌物质
生防菌能够产生多种抑菌物质,通过多种机制来抑制和杀灭病原菌,从而保护植物免受病害。例如,枯草芽孢杆菌产生枯草菌素、红霉素链霉菌产生红霉素、木霉菌产生木霉素等均能够抑制多种真菌和细菌。一些生防菌通过产生几丁质酶、葡聚糖酶、纤维素酶等降解真菌细胞壁,破坏真菌细胞结构。此外,一些生防菌产生挥发性有机化合物,具有抑菌和促进植物生长的作用。例如,木霉菌和枯草芽孢杆菌产生的2,3-丁二醇(2,3-Butanediol)和乙酸甲酯(Methyl acetate)具有抗菌活性(Compaoré et al., 2013)。
(3)诱导植物抗病性
生防菌能够通过多种机制诱导植物产生抗病性,从而提高植物对病原菌的抵抗能力。例如,一些生防菌能够使植物系统获得抗性(Systemic Acquired Resistance, SAR),这是一种由局部感染引发的全植物范围的防御反应。枯草芽孢杆菌能够通过诱导水杨酸的积累来增强植物的SAR。此外,生防菌还能诱导系统抗性(Induced Systemic Resistance, ISR),这是另一种由生防菌诱导的植物防御反应,主要通过茉莉酸(JA)和乙烯(ET)信号通路实现。生防菌通过刺激植物产生茉莉酸和乙烯,启动相关的防御基因,提高植物的抗病性(邵天蔚, 2017)。例如,荧光假单胞菌能够诱导ISR,提高植物对多种病原菌的抵抗力。前人研究发现,将一株拮抗菌株SQY162接种到盆栽番茄中后的1d内,茉莉酸途径(JA)中的关键基因 p/>72的表达量在24小时内大幅增加,直到第五天,其表达量依然保持在较高的水平(房志颖, 2016)。生防菌除了上述拮抗机制外,生防菌可以增强植物的物理屏障,提高其抵抗病原菌侵染的能力。例如:生防菌可以促进植物根系和茎叶中木质素和角质层的积累,增强植物组织的硬度,阻止病原菌的侵入。此外,生防菌能够激活植物的信号转导途径,启动一系列防御反应。例如:活性氧(ROS)的积累:生防菌可以诱导植物产生活性氧,活性氧作为信号分子能够启动植物的防御基因,提高抗病性。
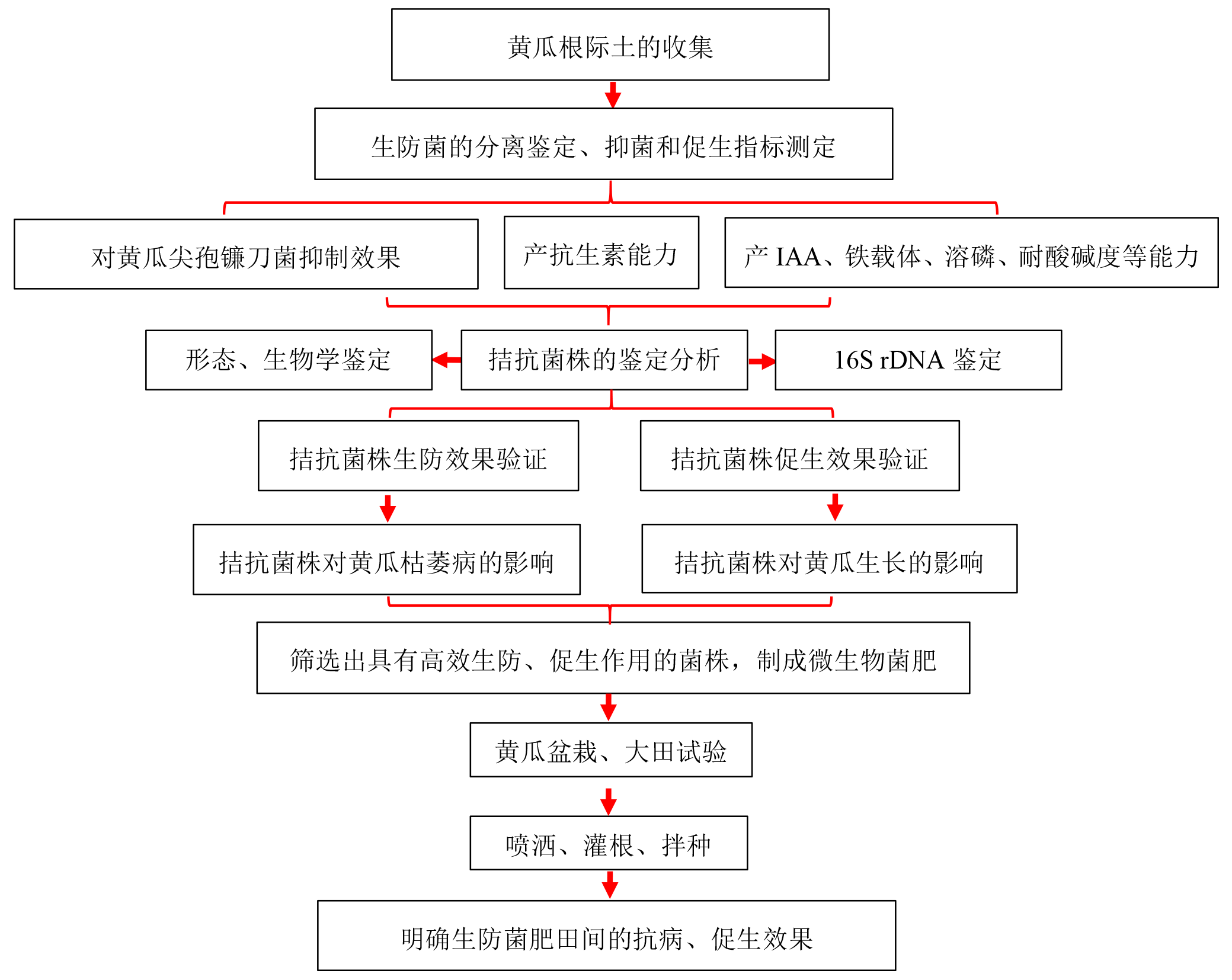
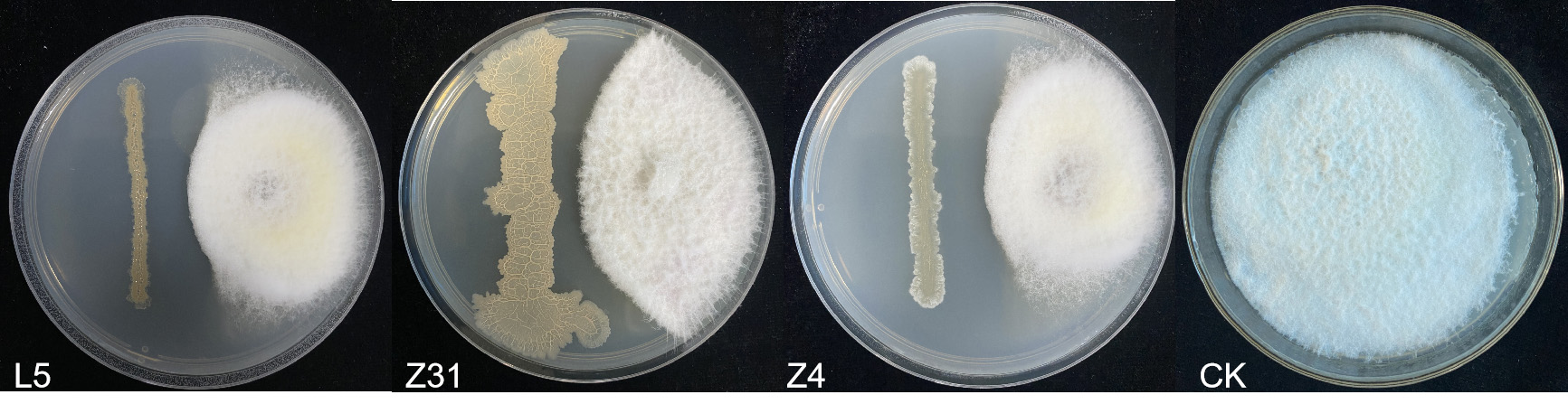
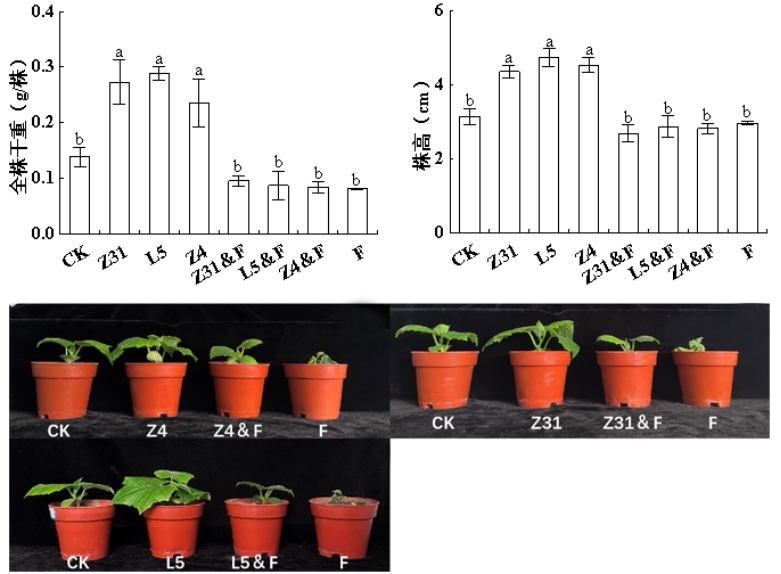
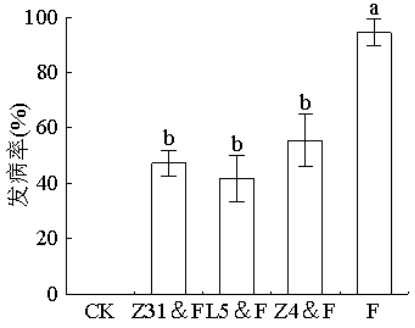
综上所述,本研究以黄瓜枯萎病为主要防治对象,从抗病性较强的黄瓜根际土壤中筛选出黄瓜专化型尖孢镰刀菌具有有拮抗作用的细菌,并对其进行鉴定和分类。同时分析了这些拮抗细菌在体外和盆栽条件下对病害发展及植株生长影响,并探讨了其可能存在的拮抗机制,为后续拮抗黄瓜枯萎病生物菌肥的制作提供理论基础。
参考文献
1.Ambrosini A, de Souza R, Passaglia L M P. Ecological role of bacterial inoculants and their potential impact on soil microbial diversity [J]. Plant and Soil, 2016, 400(1-2): 193-207.
2.Bloemberg G V, Lugtenberg B J. Molecular basis of plant growth promotion and biocontrol by rhizobacteria [J]. Current opinion in plant biology, 2001, 4(4): 343-50.
3.Cerda R, Avelino J, Gary C, et al. Primary and secondary yield losses caused by pests and diseases: assessment and modeling in coffee [J]. PLoS One, 2017, 12(1): e0169133.
4.Chen M C, Wang J P, Zhu Y J, et al. Antibacterial activity against ralstonia solanacearum of the lipopeptides secreted from the bacillus amyloliquefaciens strain FJAT-2349[J]. Journal of Applied Microbiology, 2019, 126(5):1519-1529.
5.Chowdappa P, Kumar S, Lakshmi M J, et al. Growth stimulation and induction of systemic resistance in tomato against early and late blight by Bacillus subtilis OTPB1 or Trichoderma harzianum OTPB3 [J]. Biological Control, 2013, 65(1): 109-17.
6.Compaoré C, Nielsen D S, Ouoba L, et al. Co-production of surfactin and a novel bacteriocin by Bacillus subtilis subsp. subtilis H4 isolated from Bikalga, an African alkaline Hibiscus sabdariffa seed fermented condiment [J]. International Journal of Food Microbiology, 2013, 162(3): 297-307.
7.EL-Tarabily K A, Sivasithamparam K. Potential of yeasts as biocontrol agents of soil-borne fungal plant pathogens and as plant growth promoters [J]. Mycoscience, 2006, 47(1): 25-35.
8.Haas D, Blumer C, Keel C. Biocontrol ability of fluorescent pseudomonads genetically dissected: Importance of positive feedback regulation [J]. Current Opinion in Biotechnology, 2000, 11(3): 290-7.
9.Hong Y, Pasternak J J, Glick B R. Biological consequences of plasmid transformation of the plant growth promoting rhizobacterium Pseudomonas putida GR12-2 [J]. Revue Canadienne De Microbiologie, 2011, 37(10): 796-9.
10.Kurabachew H, Wydra K. Characterization of plant growth promoting rhizobacteria and their potential as bioprotectant against tomato bacterial wilt caused by Ralstonia solanacearum [J]. Biological Control, 2013, 67(1): 75-83.
11.Ma Y, Prasad M N V, Rajkumar M, et al. Plant growth promoting rhizobacteria and endophytes accelerate phytoremediation of metalliferous soils [J]. Biotechnology Advances, 2011, 29(2): 248-58.
12.Marschner P, Crowley D, Yang C H. Development of specific rhizosphere bacterial communities in relation to plant species, nutrition and soil type [J]. Plant and Soil, 2004, 261(1/2): 199-208.
13.Raman R. The impact of Genetically Modified (GM) crops in modern agriculture: A review [J]. GM Crops Food, 2017, 8(4): 195-208.
14.Ramos-Solano B, Garcia-Villaraco A, Gutierrez-Manero F J, et al. Annual changes in bioactive contents and production in field-grown blackberry after inoculation with Pseudomonas fluorescens [J]. Plant Physiology & Biochemistry, 2014, 74: 1-8.
15.Rungin S, Indananda C, Suttiviriya P, et al. Plant growth enhancing effects by a siderophore-producing endophytic streptomycete isolated from a Thai jasmine rice plant (Oryza sativa L. cv. KDML105) [J]. Antonie Van Leeuwenhoek, 2012, 102(3): 463-72.
16.Ryu C M, Farag M A, Hu C H, et al. Bacterial volatiles induce systemic resistance in arabidopsis [J]. Plant Physiology, 2004, 134(3): 1017-26.
17.Shen S S, Choi O H, Park S H, et al. Root colonizing and biocontrol competency of Serratia plymuthica A21-4 against phytophthora blight of pepper[J]. Plant Pathology Journal, 2005, 21(1):64-67.
18.Solanki M K, Singh R K, Srivastava S , et al. Isolation and characterization of siderophore producing antagonistic rhizobacteria against Rhizoctonia solani [J]. Journal of Basic Microbiology, 2014, 54(6):585-597.
19.Stewart A, Brownbridge M, Hill R A, et al. Utilizing Soil Microbes for Biocontrol [J]. Springer Netherlands, 2010.
20.Walia A, Mehta P, Chauhan A, et al. Effect of Bacillus subtilis strain CKT1 as inoculum on growth of tomato seedlings under net house conditions [J]. Proceedings of the National Academy of Sciences India, 2014, 84(1): 145-55.
21.Zhang S, Raza W, Yang X, et al. Control of Fusarium wilt disease of cucumber plants with the application of a bioorganic fertilizer [J]. Biology & Fertility of Soils, 2008, 44(8): 1073.
22.程国亭, 王延峰, 姜文婷,等. 设施番茄土壤障碍综合防控研究进展 [J]. 中国蔬菜, 2023, 2: 16-24.
23.房志颖. 解淀粉芽孢杆菌SQY162防控土传番茄青枯病效果及其机理研究 [D]. 南京农业大学, 2016.
24.黄晓庆. 连作土壤中黄瓜枯萎病菌的致病力变化规律及强、弱致病力菌株的转录组分析 [D]. 中国农业科学院, 2018.
25.李雪萍, 徐冬丽, 刘梅金, 等. 青稞根腐病生防放线菌的筛选及防效研究 [J]. 麦类作物学报, 2022, 42(02): 246-52.
26.欧阳晓伦, 陈昭, 窦鑫, 等. 贝莱斯芽孢杆菌YX-3的筛选鉴定及其抑菌效果 [J]. 黑龙江八一农垦大学学报, 2022, 34(06): 64-70.
27.潘潇涵, 常瑞雪, 慕康国, 等. 哈茨木霉VT9-3r和枯草芽孢杆菌VT4-1x对3株马铃薯致病菌的抑制作用效果 [J]. 中国农业大学学报, 2020, 25(04): 72-81.
28.邵天蔚. 7株人参病害生防菌株的筛选、鉴定及抑菌效果评价初步研究 [D]. 北京协和医学院, 2017.
29.王丽丽, 朱诗君, 金树权, 等. 黄瓜枯萎病拮抗菌株的筛选及其生物防效 [J]. 浙江农业科学, 2019, 60(09): 1525-1527.
30.王小慧, 张国漪, 张鹏, 等. 生防菌根系定殖竞争作用对西瓜枯萎病发病机理的影响 [J]. 微生物学通报, 2012, 39(11): 1603-13.
31.王英姿, 纪明山, 祁之秋, 等.利用木霉菌生物防治黄瓜枯萎病研究进展[J].北方园艺,2008,193(10):81-82.
32.王智荣, 梅小飞, 杜木英, 等. 荧光假单胞菌ZX对采后锦橙绿霉病的防治及其抑菌机制 [J]. 微生物学报, 2019, 59(05): 950-64.
33.徐彦刚, 贺振, 李瑞, 等. 黄瓜枯萎病研究进展 [J]. 中国瓜菜, 2018, 31(06): 1-6.
34.闫敏, 庞金梅, 焦晓燕, 等.番茄枯萎病对植株维管束危害及抗氧化系统影响的研究[J].中国生态农业学报, 2013, 21(05): 615-620.